2021年9月22日��,中國科學(xué)院上海藥物研究所徐華強(qiáng)/蔣軼團(tuán)隊(duì)����,聯(lián)合浙江大學(xué)張巖團(tuán)隊(duì),在Nature雜志上發(fā)表了最新研究成果“Structures of full-length glycoprotein hormone receptor signaling complexes”����,首次解析了糖蛋白激素GPCR,即全長黃體生成素/絨毛膜促性腺激素受體(luteinizing hormone/choriogonadotropin receptor, LHCGR)處于失活狀態(tài)和多種激活狀態(tài)下的四個(gè)結(jié)構(gòu)���。該工作揭示了絨毛膜促性腺激素(CG)識(shí)別LHCGR的分子機(jī)制����,揭示了1期臨床實(shí)驗(yàn)的小分子化合物Org43553與受體LHCGR相互作用細(xì)節(jié)模式�����;鑒定了糖蛋白激素選擇性結(jié)合LHCGR和促卵泡激素(follicle-stimulating hormone�����,F(xiàn)SH)受體的關(guān)鍵氨基酸殘基���;提出了激素配體激活受體的“Push and Pull”模型�����。這些工作對(duì)理解糖蛋白激素識(shí)別和激活GPCR的機(jī)制,為臨床開發(fā)替代激素治療的小分子藥物具有重要的理論和現(xiàn)實(shí)意義�。
激素是人體的化學(xué)信使,控制著各個(gè)器官的生理功能�����,而下丘腦和腦下垂體是內(nèi)分泌激素的控制中心��。傳統(tǒng)內(nèi)分泌系統(tǒng)由三大分支組成�,即下丘腦-垂體-性腺軸(HPG)、下丘腦-垂體-甲狀腺軸(HPT)和下丘腦-垂體-腎上腺軸(HPA)�。其中,三種促性腺激素��,包括促黃體生成素(luteinizing hormone,LH)����,促卵泡激素(follicle-stimulating hormone,F(xiàn)SH)和絨毛膜促性腺激素(chorionic gonadotropin�����,CG)是糖蛋白激素����,調(diào)控HPG軸的關(guān)鍵生理功能,包括人體的性別發(fā)育��,精子發(fā)生和卵子成熟�,以及促進(jìn)第二性特征的發(fā)育及維持。另一類糖蛋白激素促甲狀腺激素(thyroid-stimulating hormone�����,TSH)是HPT軸調(diào)節(jié)的關(guān)鍵糖蛋白激素����,主要通過調(diào)控機(jī)體甲狀腺素的水平從而調(diào)節(jié)人體代謝�。這些激素均為臨床重要的治療藥物�,其中FSH和LH用于輔助生殖及體外受精���,以及治療女性不孕癥和男性促性腺功能減退癥等����;CG用來誘導(dǎo)女性排卵�,增加男性精子數(shù)量等。TSH與131I聯(lián)合應(yīng)用于甲狀腺癌術(shù)后患者�����,抑制和消融殘余癌組織等1�����。盡管幾十年來糖蛋白激素的臨床應(yīng)用取得了成功�����,年銷售額達(dá)數(shù)十億美元�����,但糖蛋白激素如何激活人體細(xì)胞中受體的機(jī)制仍然未知��。
四種糖蛋白激素的整體三維結(jié)構(gòu)高度相似,均由一條保守的α鏈和激素特異性的β鏈組成����。糖蛋白激素受體為A類G蛋白偶聯(lián)受體(G protein-coupled receptor, GPCR),其中���,LH和CG共同作用于促黃體生成素/絨促性素受體(LHCGR)��,F(xiàn)SH作用于卵泡刺激素受體(FSHR)�,TSH作用于促甲狀腺激素受體(TSHR)來發(fā)揮生理功能�。與大多數(shù)A類GPCR不同,糖蛋白激素受體有約由340-420個(gè)氨基酸構(gòu)成的巨大N端胞外區(qū)結(jié)構(gòu)域(ECD)���,該結(jié)構(gòu)域由富含亮氨酸的重復(fù)序列構(gòu)成�����,且存在復(fù)雜的糖基化修飾����。鉸鏈區(qū)連接受體的ECD和跨膜區(qū)構(gòu)成全長受體(圖1)��。2005年Wayne A. Hendrickson研究組首次解析了FSH 和FSHR的N端(1-268)胞外段的復(fù)合物晶體結(jié)構(gòu)����,揭示了FSH與受體相互作用的細(xì)節(jié)模式,同時(shí)他們提出了該受體在細(xì)胞膜表面可能以二聚體(dimer)的形式被激活進(jìn)而發(fā)揮生理功能2�����。2012年�����,Xiaolin He 研究組解析了FSH與FSHR完整胞外域的復(fù)合物晶體結(jié)構(gòu)�,進(jìn)一步確證了連接受體胞外端和受體跨膜結(jié)構(gòu)域的鉸鏈區(qū)在激素識(shí)別和受體激活過程中的關(guān)鍵作用,并提出糖蛋白激素受體的激活模型����,認(rèn)為三聚體可能是受體發(fā)揮生理功能的形式3。然而���,由于糖蛋白激素受體結(jié)構(gòu)的特殊性����,體外獲得全長的該類蛋白困難重重�����。目前尚無全長糖蛋白激素及其受體復(fù)合物的結(jié)構(gòu)被報(bào)道,極大地限制了人們對(duì)于該類受體的激素選擇性����,以及受體激活機(jī)制的理解。同時(shí)���,結(jié)構(gòu)信息的缺乏也制約了靶向該類受體的小分子治療藥物的研發(fā)����。
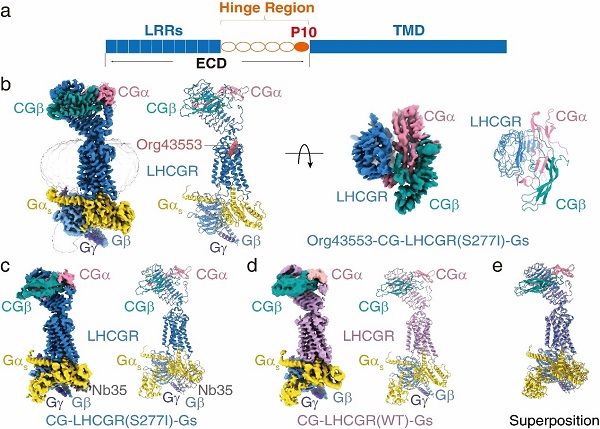
聯(lián)合研究團(tuán)隊(duì)采用單顆粒冷凍電鏡技術(shù)����,首次解析了3個(gè)近原子分辨率的全長LHCGR處于激活狀態(tài)下的結(jié)構(gòu)(圖1),包括結(jié)合內(nèi)源性激素CG的LHCGR(野生型)受體結(jié)構(gòu)(4.3埃)���、結(jié)合內(nèi)源性激素CG的LHCGR(含持續(xù)性激活突變S277I)受體結(jié)構(gòu)(3.8埃)以及結(jié)合內(nèi)源性激素CG和小分子化合物Org43553的LHCGR(含持續(xù)性激活突變S277I)受體結(jié)構(gòu)(3.2埃)��。
圖1-糖蛋白激素受體結(jié)構(gòu)模式圖及LHCGR受體與CG和Gs蛋白復(fù)合物的冷凍電鏡結(jié)構(gòu)
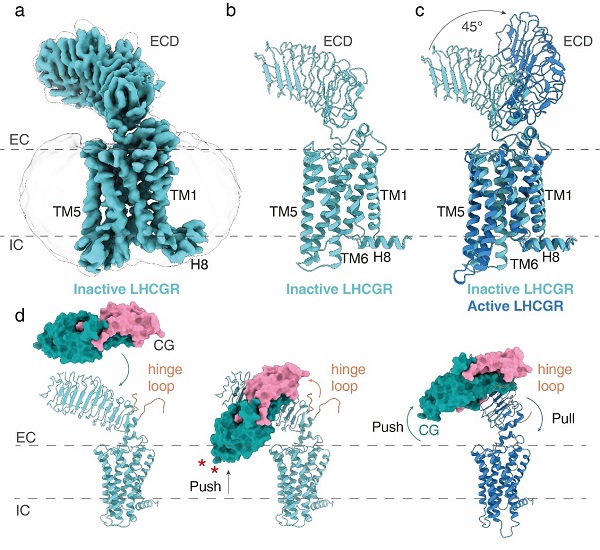
該研究首次揭示了全長LHCGR的結(jié)構(gòu)�,以及CG與LHCGR相互作用的細(xì)節(jié)��。研究人員通過大量嘗試��,克服了全長失活受體構(gòu)象高度不穩(wěn)定的技術(shù)難題,最終解析了失活狀態(tài)下全長LHCGR的電鏡結(jié)構(gòu)���,分辨率為3.8埃。通過對(duì)比激活LHCGR結(jié)構(gòu)��,研究人員發(fā)現(xiàn)受體的ECD發(fā)生了大約45度的偏轉(zhuǎn)���。通過進(jìn)一步結(jié)構(gòu)分析和功能試驗(yàn)驗(yàn)證��,最終提出了LHCGR受體“Push and Pull”的受體激活模型(圖2)��。這也是第一個(gè)全長單獨(dú)GPCR的電鏡結(jié)構(gòu)����。
圖2-LHCGR失活狀態(tài)電鏡結(jié)構(gòu)與激活狀態(tài)結(jié)構(gòu)比較以及受體激活模型
此外���,研究人員還解析了處于1期臨床試驗(yàn)中的小分子化合物Org43553與LHCGR相互作用的分子細(xì)節(jié)�,揭示了Org43553的結(jié)合口袋���,為臨床開發(fā)針對(duì)LHCGR����,F(xiàn)SHR和TSHR的選擇性小分子藥物替代激素治療提供了重要的結(jié)構(gòu)模板。
綜上�,本研究解析了首個(gè)糖蛋白激素受體——LHCGR的全長結(jié)構(gòu),揭示了LHCGR與其內(nèi)源性激素配體CG的相互作用模式�����,解決了LHCGR和FSHR對(duì)于三種激素LH���,CG��,F(xiàn)SH的選擇性問題�����。同時(shí)����,研究率先提出了LHCGR的“Push and Pull”激活模型��,并證實(shí)了這一獨(dú)特的激活模型在糖蛋白GPCR中的普遍性�。最后,本研究闡明了小分子化合物Org43553識(shí)別LHCGR的分子基礎(chǔ)���,為靶向糖蛋白激素受體的小分子藥物開發(fā)奠定了結(jié)構(gòu)基礎(chǔ)����。
本課題由中國科學(xué)院上海藥物研究所徐華強(qiáng)/蔣軼研究團(tuán)隊(duì)聯(lián)合浙江大學(xué)張巖團(tuán)隊(duì),精誠合作��,合力攻關(guān)�����,并在中國科學(xué)院上海藥物研究所蔣華良院士�����、清華大學(xué)協(xié)和醫(yī)院張抒揚(yáng)教授�,以及英國劍橋大學(xué)Tristan Croll的協(xié)助下完成���。上海藥物研究所博士生段佳�����、徐沛雨�����、上海藥物研究所程曦副研究員和浙江大學(xué)基礎(chǔ)醫(yī)學(xué)院附屬邵逸夫醫(yī)院毛春友研究員��,為本文共同第一作者�。該工作得到國家重點(diǎn)研發(fā)計(jì)劃、上海市市級(jí)科技重大專項(xiàng)����、科技部重點(diǎn)研發(fā)計(jì)劃、中科院戰(zhàn)略性先導(dǎo)科技專項(xiàng)��、國家自然科學(xué)基金委及浙江省自然基金委等項(xiàng)目的資助�。
1.Jiang, X., Dias, J. A. & He, X. Structural biology of glycoprotein hormones and their receptors: insights to signaling. Mol Cell Endocrinol 382, 424-451, doi:10.1016/j.mce.2013.08.021 (2014).
2.Fan, Q. R. & Hendrickson, W. A. Structure of human follicle-stimulating hormone in complex with its receptor. Nature 433, 269-277, doi:10.1038/nature03206 (2005).
3.Jiang, X. et al. Structure of follicle-stimulating hormone in complex with the entire ectodomain of its receptor. Proc Natl Acad Sci U S A 109, 12491-12496, doi:10.1073/pnas.1206643109 (2012).
本研究部分主創(chuàng)人員合影。左起蔣華良�����、程曦���、蔣軼���、何欣恒、段佳���、尹萬超����、劉秋楓、徐沛雨和徐華強(qiáng)�����。